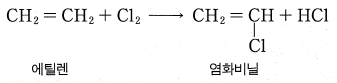미인대회 출신 처제 엉덩이

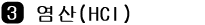
1) 개요
-
염산(hydrochloric acid)은 염화수소(hydrogen chloride, HCl)의 수용액
-
1823년 영국에서 르블랑법 (Leblanc process)의 부산물로 생산되기 시작하였고, 중요한 무기산 중의 하나
-
인체에서도 음식물의 소화를 돕는 위산으로서 위에서 분비
-
공업적 제법으로는 합성 염산법과 부생 염산법
2) 성질과 용도
-
염화수소는 무색의 자극성이 강한 기체로 공기보다 무겁고 암모니아 다음으로 물에 잘 녹음.
-
진한 염산은 비중이 1. 18이고, 염화수소 가스가 약35% 녹아 있는 수용액으로 자극적 인 냄새
-
염화수소가 든 병의 마개를 열 때 흰 연기가 나오는 것은 물에 녹아 있던 염화수소가 가스로 되어 나오면서 공기 중의 수분과 만나서 염산의 작은 방울 생성
-
염화수소는 암모니아와 만나 짙은 흰 연기로 보이는데,
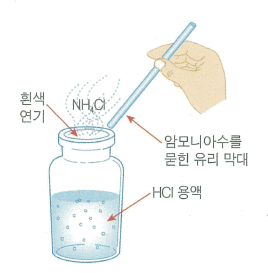 이것은 염화암모늄의 작은 알갱이가 형성
이것은 염화암모늄의 작은 알갱이가 형성
-
염산은 강산으로 이온화 경향이 큰 금속과 반응하여 수소 가스를 발생시키고, 이온화 경향이 작은 수은· 금· 백금·은 등과는 반응하지 않으나, 구리· 철·니켈 등과는 가열하면 이들 금속이 녹음.
-
염산의 경우 무기약품· 염료· 의약품의 제조, 녹말의 당화 등에도 사용되나 가장 소비량이 큰 용도는 글루탐산나트륨 · 간장 등 아미노산 조미료의 제조 등에 사용
그림 Ⅱ-12 염산과 암모니아의 반응
3) 염산의 제조
-
공업적으로 염산을 얻는 방법
-
합성 염산법 : 염소와 수소가스를 적접 합성하는 법
-
부생 염산법 : 유기 염소계 화합물을 제조할 때 부생 - 최근에는 르블랑법의 부생 염산은 거의 생산되지 않음.
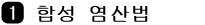
-
소금 수용액 (NaC I)을 전기 분해하여 수산화 나트륨(NaOH)을 제조할 때 발생되는 수소 기체(H2) 와 염소 기체 (Cl2)를 서로 반응시켜 염화수소 기체 (HCl)를 제조
-
수소 기체(H2)와 염소 기체 (Cl2)는 가열하거나 자외선을 찍어 주면 폭발적으로 반응
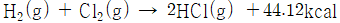
그림 Ⅱ-12 합성 염산법의 제조 공정
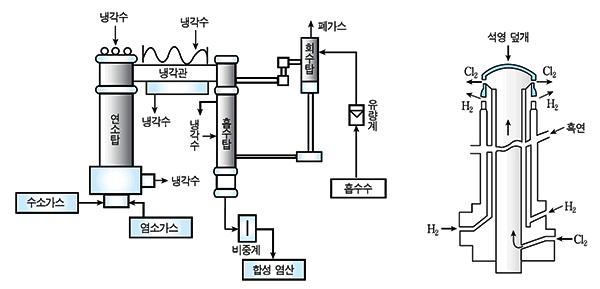
그림 Ⅱ-13 합성 염산법의 제조 장치 그림 Ⅱ-14 연소탑의 버너
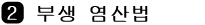
-
최근에는 염소가 유기 합성 공정에 많이 사용되기 때문에 그 부산물로서 염산 제조
-
탄화수소의 염소화에 따라 유기 염소 화합물을 만들 때 부산물로 생성되는 염산을 정제해서 순수한 염산 제조

그림 Ⅱ-15 염산 제조 공장

2016 동기부여 영상 ▶ 잠재력





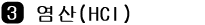
 이것은 염화암모늄의 작은 알갱이가 형성
이것은 염화암모늄의 작은 알갱이가 형성